Báo Bình Dương điện tử - www.baobinhduong.vn
Tổng Biên tập: LÊ MINH TÙNG
Phó Tổng Biên tập: HUỲNH MINH DÂN - NGUYỄN QUỐC LIÊM
Với đa số đại biểu tham gia biểu quyết tán thành, Quốc hội đã chính thức thông qua Luật sửa đổi, bổ sung một số điều của Luật Dược.
Các đại biểu quốc hội biểu quyết thông qua Luật sửa đổi, bổ sung một số điều của Luật Dược.
Chiều 21/11, các đại biểu quốc hội đã biểu quyết bằng hình thức bấm nút điện tử để thông qua Luật sửa đổi, bổ sung một số điều của Luật Dược.
Luật sẽ có hiệu lực thi hành kể từ ngày 1/1/2025.
Bấm nút thông qua toàn bộ dự thảo Luật Dược
Trước khi các đại biểu quốc hội bấm nút thông qua toàn bộ dự thảo Luật sửa đổi, bổ sung một số điều của Luật Dược, Quốc hội tiến hành biểu quyết để thông qua 2 nội dung.
Thứ nhất, đối với khoản 23 Điều 1 về quyền và trách nhiệm của các cơ sở tổ chức chuỗi nhà thuốc, các nhà thuốc trong chuỗi nhà thuốc: Kết quả biểu quyết cho thấy, có 427/434 đại biểu quốc hội tham gia biểu quyết tán thành (chiếm 89,14%), Quốc hội thông qua nội dung này.
Thứ hai, khoản 30 Điều 1 về: Thẩm quyền, hồ sơ, thủ tục, thời gian cấp, gia hạn của giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc: Kết quả biểu quyết cho thấy, có 413/419 đại biểu quốc hội tham gia biểu quyết tán thành (86,22%), Quốc hội thông qua nội dung này.
Sau khi Quốc hội biểu quyết thông qua 2 nội dung trên, Phó Chủ tịch Quốc hội Nguyễn Thị Thanh đề nghị các đại biểu quốc hội biểu quyết để thông qua toàn bộ dự thảo Luật sửa đổi, bổ sung một số điều của Luật Dược.
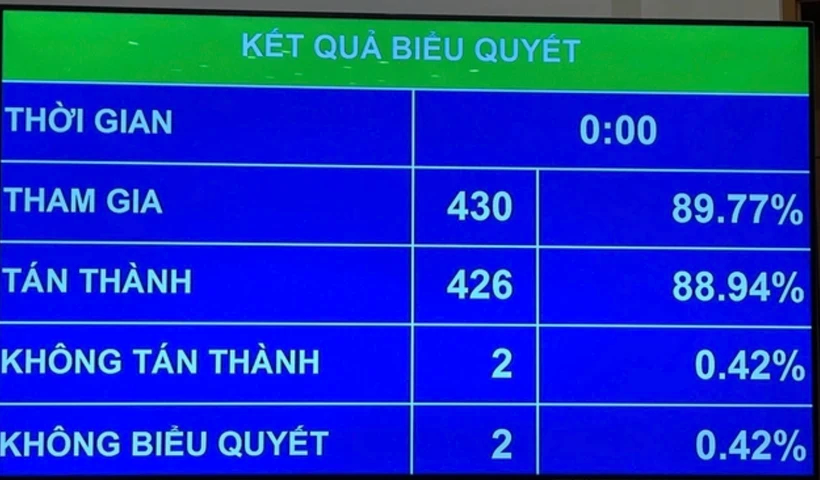
Kết quả biểu quyết cho thấy, có 426/430 (chiếm 88,94%) đại biểu quốc hội có mặt tán thành Luật sửa đổi, bổ sung một số điều của Luật Dược. Như vậy, với đa số đại biểu tham gia biểu quyết tán thành, Quốc hội đã chính thức thông qua Luật sửa đổi, bổ sung một số điều của Luật Dược.
Theo lãnh đạo Bộ Y tế, việc xây dựng Luật sửa đổi, bổ sung một số điều của Luật Dược nhằm: Đảo đảm người dân được tiếp cận thuốc chất lượng, kịp thời, giá cả hợp lý; Kịp thời tháo gỡ các khó khăn, vướng mắc về thể chế, pháp luật trong hoạt động quản lý thuốc; Đảm bảo thuốc cho phòng, chống dịch bệnh và các trường hợp cấp bách phát sinh trong thực tiễn; Tiếp tục cải cách thủ tục hành chính trong hoạt động về dược, bảo đảm tăng khả năng tiếp cận thuốc của người dân, tạo thuận lợi cho người dân, doanh nghiệp.
7 nhóm điểm mới cơ bản
Trước đó, trước khi các đại biểu quốc hội tiến hành biểu quyết thông qua dự thảo Luật dược, Quốc hội đã nghe Chủ nhiệm Ủy ban Xã hội Nguyễn Thúy Anh trình bày tóm tắt Báo cáo tiếp thu, giải trình và chỉnh lý dự thảo Luật sửa đổi, bổ sung một số điều của Luật Dược.
Bà Nguyễn Thúy Anh đọc Báo cáo số 1062/BC-UBTVQH15 ngày 20/11/2024 (Báo cáo số 1062) về tiếp thu, giải trình và chỉnh lý dự thảo Luật sửa đổi, bổ sung một số điều của Luật Dược (dự thảo Luật) và Hồ sơ của dự thảo Luật. Trong quá trình tiếp thu, chỉnh lý, Ủy ban Thường vụ Quốc hội đã chỉ đạo quán triệt và thực hiện chủ trương đổi mới tư duy trong xây dựng pháp luật, bảo đảm các quy định rõ ràng, thực chất, ngắn gọn, dễ hiểu, dễ thực hiện, bám sát thực tiễn; tăng cường phân cấp, phân quyền gắn với nhiệm vụ, quyền hạn của các cơ quan, tổ chức, cá nhân để nâng cao năng lực thực thi; đơn giản hóa thủ tục hành chính; chỉ quy định những nội dung đúng thẩm quyền của Quốc hội; giao Chính phủ, các bộ quy định nội dung theo thẩm quyền để kịp thời sửa đổi, bổ sung khi cần thiết.
Dự thảo Luật sau khi chỉnh lý gồm 03 điều, trong đó Điều 1 sửa đổi 50 điều, bãi bỏ 02 điểm, 02 khoản và 01 điều của Luật Dược hiện hành, bổ sung 03 điều mới; Điều 2 sửa đổi, bổ sung Phụ lục số 01 ban hành kèm theo Luật Giá số 16/2023/QH15; Điều 3 về Điều khoản thi hành.
So với Luật hiện hành, dự thảo Luật sửa đổi, bổ sung một số điều của Luật Dược có 7 nhóm điểm mới cơ bản:
1. Chính sách của Nhà nước về dược được tiếp tục hoàn thiện, thể chế hóa quan điểm của Đảng nhằm mục tiêu phát triển ngành công nghiệp dược Việt Nam thành ngành công nghiệp mũi nhọn. Theo đó, dự thảo Luật bổ sung một số quy định mang tính đột phá hơn so với Luật Dược năm 2016 để thu hút đầu tư và thúc đẩy hơn nữa việc nghiên cứu phát triển sản xuất thuốc, nguyên liệu làm thuốc như chính sách ưu tiên về các thủ tục hành chính khi cấp giấy đăng ký lưu hành, cấp phép nhập khẩu; chính sách áp dụng các cơ chế ưu đãi, hỗ trợ từ các quỹ hỗ trợ cho hoạt động khoa học và công nghệ trong nghiên cứu, phát triển, thử nghiệm lâm sàng, chuyển giao công nghệ, sản xuất thuốc, nguyên liệu làm thuốc; chính sách giữ giá, giảm giá đối với một số nhóm thuốc chuyển giao công nghệ sản xuất; chính sách chuyển đổi số trong các hoạt động về dược; xác định quy mô dự án thuộc lĩnh vực dược được áp dụng ưu đãi, hỗ trợ đầu tư đặc biệt và giao Chính phủ quy định chi tiết để bảo đảm tính khả thi, đưa các chính sách của Nhà nước về dược và phát triển công nghiệp dược đi vào cuộc sống.
2. Tạo hành lang pháp lý cho các hình thức, phương thức kinh doanh mới, đó là: quy định cơ sở tổ chức chuỗi nhà thuốc là một loại hình cơ sở kinh doanh dược riêng biệt, điều kiện kinh doanh, quyền và trách nhiệm của cơ sở tổ chức chuỗi nhà thuốc, các nhà thuốc trong chuỗi nhà thuốc, nổi bật là quyền luân chuyển thuốc và quyền luân chuyển người chịu trách nhiệm chuyên môn về dược giữa các nhà thuốc trong chuỗi nhà thuốc; quy định về kinh doanh thuốc, nguyên liệu làm thuốc theo phương thức thương mại điện tử, cụ thể, bổ sung quy định phương tiện điện tử, loại thuốc, nguyên liệu làm thuốc được phép kinh doanh theo phương thức thương mại điện tử; bổ sung quyền, trách nhiệm của các cơ sở kinh doanh dược theo phương thức này.
3. Cụ thể hóa quyền và trách nhiệm của cơ sở kinh doanh dược có vốn đầu tư nước ngoài ngay trong Luật để bảo đảm tính công khai, minh bạch trong quản lý nhà nước.
4. Mở rộng quyền của cơ sở sản xuất, cơ sở xuất khẩu, nhập khẩu, cơ sở bán buôn thuốc, nguyên liệu làm thuốc trong việc bán trực tiếp cho một số cơ sở y tế, cơ sở cai nghiện ma túy, cơ sở kiểm nghiệm, cơ sở nghiên cứu, đào tạo và một số cơ sở khác; cho phép cơ sở khám bệnh, chữa bệnh nhập khẩu thuốc phục vụ nhu cầu điều trị đặc biệt của bệnh nhân tại cơ sở khám bệnh, chữa bệnh.
5. Đẩy mạnh cải cách thủ tục hành chính trong đăng ký lưu hành thuốc, nguyên liệu làm thuốc theo hướng phân loại các thuốc, nguyên liệu làm thuốc dựa trên các cấp độ khác nhau về tính chất của thuốc cũng như việc lưu hành để điều chỉnh hồ sơ, thủ tục, thời hạn cấp, gia hạn, thay đổi, bổ sung giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc tương ứng nhằm tăng khả năng sớm tiếp cận thuốc cho người dân mà vẫn đảm bảo hiệu lực quản lý nhà nước, kiểm soát chất lượng, an toàn và hiệu quả của thuốc; bổ sung quy định để hạn chế cấp số đăng ký lưu hành trùng lặp. Đồng thời, có quy định đặc thù về hồ sơ, thủ tục đăng ký thuốc, nguyên liệu làm thuốc, kiểm nghiệm thuốc và kinh doanh thuốc nói chung để đáp ứng yêu cầu quốc phòng, an ninh, thiên tai, thảm họa và dịch bệnh.
6. Bãi bỏ thủ tục xác nhận nội dung thông tin thuốc. Tăng cường phân cấp, phân quyền, phát huy vai trò của Sở Y tế trong thu hồi để kịp thời xử lý thuốc vi phạm chất lượng trên địa bàn quản lý, đảm bảo sử dụng thuốc an toàn, hiệu quả.
7. Quy định các biện pháp quản lý về giá để phù hợp với Luật Giá và biện pháp đặc thù trong quản lý giá thuốc là công bố, công bố lại giá bán buôn thuốc dự kiến áp dụng đối với thuốc kê đơn, bảo đảm việc bán buôn thuốc qua các tầng nấc trung gian không vượt qua giá bán buôn dự kiến đã được công bố./.
Theo TTXVN